Кури птахофабрик усіх країн, єднайтеся!
Псевдонауковці-аферисти намагаються хибними корисними шляхами досягти матеріального збагачення без будь-якої розумової напруги та докорів сумління. Факти крадіжки чужих здобутків не обмежуються окремими особами, уже є сформовані злочинні угруповання, що пронизують наскрізь «вертикаль наукових послуг». Сформувалися мережі так званих «псевдонауковців», які за певні блага з будь-якого «клієнта» залюбки зроблять кандидата або доктора наук із забезпеченням «повного супроводу» аж до етапу затвердження вченого ступеня в Міністерстві освіти і науки.
Численні факти академічної недоброчесності виявлені в спеціалізованій вченій раді Д 55.859.04, що працює на базі двох установ – Сумського національного аграрного університету та Державного науково-контрольного інституту біотехнології і штамів мікроорганізмів. Плагіат виявляється майже у кожній роботі, що виходить з цієї «Вченої ради», а його форми дедалі стають все більш потворнішими.
Першим прикладом стане Коваленко Ірина Володимирівна, чия дисертація «Санітарно–гігієнічна оцінка дезінфікуючих засобів для передінкубаційної санації яєць та імуноактивації ембріонів курчат» на здобуття наукового ступеня кандидата ветеринарних наук зі спеціальності 16.00.06 – гігієна тварин та ветеринарна санітарія була захищена 16.06.2017 р.
Науковий керівник роботи – доктор ветеринарних наук Фотіна Ганна Анатоліївна, професор кафедри епізоотології та паразитології Сумського національного аграрного університету.
Текст дисертації можна завантажити тут.
Нижче в таблиці наведені ті місця з дисертації І. В. Коваленко, де було виявлено збіг з іншими джерелами. Однакові тексти виділені жовтим кольором, а змінені цифри (закруглені) або близькі за смислом слова – бірюзовим.
|
Коваленко Ірина Володимирівна,
дисертація
|
Інше джерело
|
|
С. 58–59
При проведенні мікробіологічного моніторингу в інкубаторіях досліджуваних птахофабрик Полтавської та Харківської областей було встановлено, що найбільша кількість виділених культур належить до представників родів Staphylocоссus і Streptococcus по 26,0 %. Решта 48,0 % виділених культур припадає на Enterobacteriаceae, мікрофлора представлена патогенними та умовно-патогенними мікроорганізмами (рис. 3.1.).
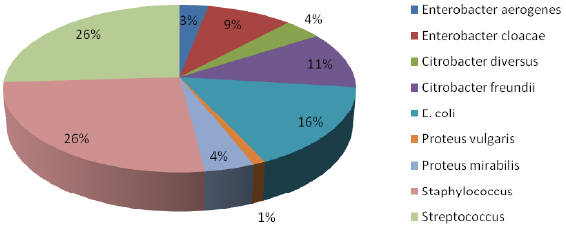
Рис. 3.1 Мікрофлора, яка виділена в інкубаторіях птахофабрик
Із загального числа виділених культур на частку кишкової палички – 16,0 %. Значна кількість виділених культур належить до роду Citrobacter – 15,0 %. З них у 11,0 % випадків був виділений вид Citrobacter freundii і в 4,0 % – Citrobacter diversus. Представники роду Enterobacter виділені у 12,0 % випадках, найбільша кількість культур припадає на Enterobacter cloacae – 9,0 % та на Enterobacter aerogenes 3 %. Штами з Proteus ізольовані у 5 % випадках, при цьому переважав вид Proteus mirabilis – 4 %, Proteus vulgaris – 1 %.
Дані в дисертацію були взяті зі статті Лиско та Макарової, тільки їх округлили.
|
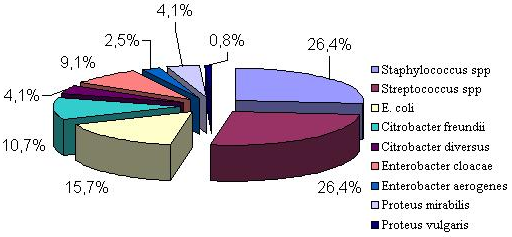
Рис. 1. Микрофлора, выделенная в инкубаториях птицефабрик Западной Сибири
Наибольшее количество выделенных культур относится к представителям родов Staphylocоссus и Streptococcus - 26,4%. Остальные 47,2% выделенных культур приходится на семейство Enterobacteriаceae. Из общего числа выделенных культур на долю кишечной палочки - 15,7%. По антигенной структуре штаммы E. coli относились к серотипам О2:К2; О6:К15; О159:К; О32:К; О164:К; О115:К; О152:К. Значительное количество выделенных культур относится к роду Citrobacter - 14,8%. Из них в 10,7% случаях выделен вид Citrobacter freundii и в 4,1% - Citrobacter diversus. Представители рода Enterobacter выделены в 11,6% случаях, наибольшее количество культур приходится на Enterobacter cloacae - 9,1%. Штаммы из рода Proteus изолированы в 4,9% случаях, при этом преобладал вид Proteus mirabilis
Джерело:
Лыско С.Б., Макарова О.А. Микробиологический мониторинг в инкубаториях. – Птицеводство. – № 8. – 2009. – с. 43–44. (стаття на нашому сайті тут або оригінал тут)
|
|
С. 77
При внутрішньошлунковому введенні препарату «СанСтим» № 1 DL50 для щурів-самок склала 2000,0±35,0 мг/кг маси тіла, а самців – 2033,0±34,3 мг/кг.
Обробка різними препаратами призводила до однакового ефекту
|
Автореферат Фотіної Г. А. (с.11)
Виходячи з результатів проведених спостережень, ЛД50 бровадезу-плюс для щурів-самок склала 2000,0±35,0 мг/кг маси тіла, самців – 2033,0±34,3 мг/кг. Таким чином даний препарат при введенні в шлунок,..
(автореферат можна завантажити тут)
|
|
С. 96
При вивченні складу еймерій в отриманій із фекалій біомасі були визначені наступні види еймерій: E. аcervulina – 49 %; E. tenella – 32 %; E. maxima – 11 %; E. necatrix – 8 %.
При контактуванні еймерій з 0,025 % водним розчином препарату процес екзогенного розвитку відбувався в 46-50 %, тоді як у контролі аналогічний показник дорівнював 76 %.
При обробці еймерій 0,05 % розчином «СанСтим» № 1 процес екзогенного розвитку не проходив у 76-82 % ооцист; 0,1 % – 96 – 98 %, а 0,25 % та 0,3 % – споруляція взагалі не відбувалася (табл. 3.23). При цьому, найменшу стійкість до 0,025 % розчину препарату реєстрували серед ооцист E. maxima, найвищу – E. аcervulina.
Необхідно відзначити, що через одну добу після постановки проб на споруляцію, видимих змін у морфології ооцист не відмічали. На другу-третю добу спостерігалось руйнування окремих ділянок оболонки ооцист (частіше – бічних).
Таким чином, водні розчини «СанСтим» № 1 у 0,025; 0,05 та 0,1 % концентраціях уповільнюють розвиток ооцист еймерій, а 0,25 та 0,3 % – різко уповільнюють та припиняють повністю розвиток ооцист основних видів еймерій курей.
Тобто обробка різними препаратами призводила до однакового кількісного ефекту (%% ооцист)
|
Автореферат Фотіної Г. А. (с.10–11)
Визначення дезінвазійної спроможності розчинів бровадезу-плюс. При досліджуванні складу еймерій у фекаліях птиці були визначені наступні види еймерій: E. аcervulina – 49%; E. tenella – 32%; E. maxima – 11%; E. necatrix – 8%. У процесі контактування еймерій з 0,5% розчином препарату екзогенний розвиток відбувався в 46-50%, в контролі аналогічний показник дорівнював 76%. Під впливом 1% розчину процес екзогенного розвитку не проходив у 76-82% ооцист; при 1,5% – 96-98%, а 2 та 3% – споруляція взагалі не відбувалася.
При цьому найменшу стійкість до 0,5% розчину препарату реєстрували серед ооцист E. maxima, найвищу – E. аcervulina. Необхідно відмітити, що через одну добу після постановки проб на споруляцію видимих змін у морфології ооцист не відмічали. На другу-третю добу спостерігалося руйнування окремих ділянок оболонки ооцист (частіше – бічних). Таким чином, водні розчини бровадезу-плюс в 0,5-1,5% концентраціях уповільнюють розвиток ооцист еймерій, а 2-3% – різко уповільнюють та припиняють повністю розвиток ооцист основних видів еймерій курей.
|
Як бачимо, матеріали статті С. Лиско і О. Макарової плавно увійшли в результати власних дисертаційних досліджень І. Коваленко.
Та це ще не все.
Виявляється, у 2013 р., коли Г. А. Фотіна була докторантом Сумського національного аграрного університету, а І. В. КОВАЛЕНКО аспірантом, вони надрукували статтю «Чутливість мікрофлори що ізольована в інкубаторіях до дезінфектантів» (Ветеринарна біотехнологія. – Київ, 2013. – № 22 – С. 620 – 625). (Статтю можна завантажити з нашого сайту тут, оригінал розміщений тут). Рецензентом статті був доктор вет. наук, професор В. Ю. Касіч, науковим консультантом д.вет.н., професор А. В. Березовський, а науковим керівником д.вет.н., професор Т. І. Фотіна.
Спритні науковиці не посоромились майже повністю взяти в свою статтю оприлюднені наукові дослідження Сибірського науково-дослідного інституту птахівництва.
Подивимося уважно на текст:
|
Фотіна Г. А., Коваленко І. В.,
стаття
|
Джерело:
Лыско С.Б., Макарова О.А. Микробиологический мониторинг в инкубаториях. – Птицеводство. – № 8. – 2009. – с. 43–44. (посилання див. вище)
|
|
(Вступ)
Однією з головних складових технологічного циклу птахівничого підприємства є інкубаторій [1].
…
В інкубаційних і вивідних шафах, залах інкубаторію відбувається максимальна концентрація яєць і добових курчат. Створюються оптимальні умови температури і вологості для біологічного об'єкта (ембріон-курча), а також для патогенної та умовно-патогенної мікрофлори…
Через яйце передаються всі бактеріальні хвороби птахів – як трансоваріально, так і за рахунок контамінації шкаралупи з наступним всмоктуванням поверхневої мікрофлори в підшкаралупну оболонку. У процесі інкубації відбувається максимальне збільшення мікробного потенціалу. Зростає ймовірність аерогенного зараження курчат на виводі бактеріальними хворобами. Вважливим ветеринарно-санітарним заходом при інкубації яєць є їх дезінфекція [4].
|
Одной из главных составляющих технологического цикла птицеводческого предприятия является инкубаторий. В инкубационных и выводных шкафах, залах инкубатория происходит максимальная концентрация яиц и суточных цыплят. Создаются оптимальные условия температуры и влажности для биологического объекта (эмбрион-цыпленок), а также для патогенной и условно-патогенной микрофлоры. Через яйцо передаются все бактериальные болезни птиц - как трансовариально, так и за счет контаминации скорлупы с последующим всасыванием поверхностной микрофлоры в подскорлупные оболочки. В процессе инкубации происходит максимальное увеличение микробного потенциала. Возрастает вероятность аэрогенного заражения цыплят на выводе бактериальными болезнями. Важное место в системе ветеринарно-санитарных мероприятий занимает дезинфекция,..
|
|
Мета досліджень провести мікробіологічний моніторинг інкубації і вивчити активність дезінфікуючих засобів відносно ізольованих штамів мікроорганізмів, виділених на птахо підприємствах Північно-Східної України.
Матеріали та методи досліджень.
…
Об’єктом дослідження були змиви з поверхні інкубаційних яєць, інкубаційних та вивідних шаф, повітря вивідних і інкубаційних шаф, відходи інкубації.
…
У загиблих ембріонів досліджували хоріоалантоісну рідину і вміст жовткового мішка. Індикацію та ідентифікацію мікроорганізмів проводили за загальноприйнятими у мікробіології методиками з використанням простих (МПБ, МПА) і диференційно-діагностичних (Ендо, ВСА, ЖСА, Кліглера, Сіммонса та ін.) середовищ.
Дезінфікуючу активність препаратів визначали при знезараженні поверхонь тест-об'єктів з дерева контамінованих тест-мікробами з білковим захистом. В якості тест-культур використовували польові штами, виділені на птахофабриках. Для білкового захисту застосовували інактивовану сироватку крові коня.
На дерев'яні тест-об’єкти наносили суміш тест-культури та сироватки крові коня з розрахунку 1 мл двохмільярдної мікробної суспензії і 0,5 мл сироватки на один тест-об’єкт. Після повного висихання поверхні обробляли робочими розчинами препаратів за допомогою пульверизатора з розрахунку 5 мл на один тест-об’єкт. Після 1, 3 і 24-х годин експозиції проводили контроль якості дезінфекції.
Випробувана дезінфікуюча активність 5 препаратів, а саме: Бровадез-плюс, Бі-дез, Глютекс, Екоцид С, Віроцид – в концентраціях, відповідних інструкцій (листівок-вкладок) виробників.
|
Цель исследований - провести микробиологический мониторинг инкубации и изучить активность дезинфицирующих средств в отношении полевых штаммов микроорганизмов, выделенных в птицефабриках Западной Сибири.
Объектом исследования были смывы с поверхности инкубационных яиц, инкубационных и выводных шкафов, воздух выводных и инкубационных шкафов, отходы инкубации.
...
У погибших эмбрионов исследовали хориоалантоисную жидкость и содержимое желточного мешка. Индикацию и идентификацию микроорганизмов проводили по общепринятым в микробиологии методикам с использованием простых (МПБ, МПА) и дифференциально-диагностических (Эндо, ВСА, ЖСА, Клиглера, Симмонса и др.) сред.
Дезинфицирующую активность препаратов определяли при обеззараживании поверхностей тест-объектов из дерева контаминированных тест-микробами с белковой защитой. В качестве тест-культур использовали полевые штаммы, выделенные на птицефабриках. Для белковой защиты применяли инактивированную сыворотку крови лошади. На деревянные тест-объекты наносили смесь тест-культуры и сыворотки крови лошади из расчета 1 мл 2-милиардной микробной взвеси и 0,5 мл сыворотки на один тест-объект. После полного высыхания поверхности обрабатывали рабочими растворами препаратов при помощи пульверизатора из расчета 5 мл на один тест-объект. После 1, 3 и 24-х часов экспозиции проводили контроль качества дезинфекции.
…
Испытана дезинфицирующая активность 5 препаратов - дезконтен, бромосепт-50, экоцид С, дирак плюс, глютекс - в концентрациях, согласно инструкциям по применению.
|
|
Дезінфікуючу активність препаратів визначали при знезараженні поверхонь тест-об'єктів з дерева контамінованих тест-мікробами з білковим захистом. В якості тест-культур використовували польові штами, виділені на птахофабриках. Для білкового захисту застосовували інактивовану сироватку крові коня. На дерев'яні тест-об’єкти наносили суміш тест-культури та сироватки крові коня з розрахунку 1 мл двохмільярдної мікробної суспензії і 0,5 мл сироватки на один тест-об’єкт. Після повного висихання поверхні обробляли робочими розчинами препаратів за допомогою пульверизатора з розрахунку 5 мл на один тест-об’єкт. Після 1, 3 і 24-х годин експозиції проводили контроль якості дезінфекції.
Змиви з оброблюваних поверхонь брали стерильними ватними тампонами на стерильний фізіологічний розчин.
|
Дезинфицирующую активность препаратов определяли при обеззараживании поверхностей тест-объектов из дерева контаминированных тест-микробами с белковой защитой. В качестве тест-культур использовали полевые штаммы, выделенные на птицефабриках. Для белковой защиты применяли инактивированную сыворотку крови лошади. На деревянные тест-объекты наносили смесь тест-культуры и сыворотки крови лошади из расчета 1 мл 2-милиардной микробной взвеси и 0,5 мл сыворотки на один тест-объект. После полного высыхания поверхности обрабатывали рабочими растворами препаратов при помощи пульверизатора из расчета 5 мл на один тест-объект. После 1, 3 и 24-х часов экспозиции проводили контроль качества дезинфекции. Смывы с обрабатываемых поверхностей брали стерильными ватными тампонами на стерильный физиологический раствор.
|
|
Результати досліджень
Досліджуваний матеріал висівали на рідкі поживні середовища (м'ясо-пептони і сольовий бульйон). При наявності росту на рідких середовищах проводили підтверджуючий посів на щільні диференційно-діагностичні середовища: Ендо, ВСА, МПА (для ентеробактерій) і елективних-сольовий агар (для стафілококів) у відповідності з діючими інструкціями.
Мікрофлора, виділена в інкубаторіях птахофабрик Північно-східного регіону України була представлена патогенними та умовно-патогенними мікроор-ганізмами (рис. 1).
Найбільша кількість виділених культур відноситься до представників родів Staphylocоссus і Streptococcus – 26,4 %. Решта 47,2% виділених культур припадає на сімейство Enterobacteriаceae. Із загального числа виділених культур на частку кишкової палички – 15,7 %. За антигенною структурою штами E. coli відносилися до серотипів О2: К2; О6: К15; О159: К; О32: К; О164: К; О115: К; О152: К.
Значна кількість виділених культур відноситься до роду Citrobacter – 14,8 %. З них у 10,7 % випадках виділений вид Citrobacter freundii і в 4,1% – Citrobacter diversus.
Представники роду Enterobacter були виділені в 11,6 % випадках, найбільша кількість культур припадала на Enterobacter cloacae – 9,1 %. Штами з роду Proteus ізольовані в 4,9 % випадках, при цьому переважав вид Proteus mirabilis.
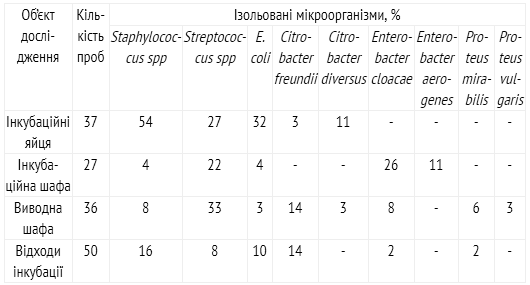
При аналізі мікрофлори в змивах з поверхні інкубаційних яєць переважали Staphylocоссus spp – 54%, E. coli – 32% і Streptococcus sрp – 27% (табл. 1). В інкубаційних шафах домінуючими видами були мікроорганізми з роду Enterobacter і Streptococcus sрp. Найбільша кількість різних видів мікроорганізмів реєстрували у вивідних шафах: Streptococcus sрp – 33%, Citrobacter freundii – 14%, Staphylocоссus spp і Enterobacter cloacae по 8%. При дослідженні відходів інкубації найбільш часто ідентифікували Staphylocоссus spp. – 16%, Citrobacter freundii – 14% та E. coli – 10%.
|
Исследуемый материал высевали на жидкие питательные среды (мясо-пептонный и солевой бульон). При наличие роста на жидких средах проводили подтверждающий посев на плотные дифференциально-диагностические среды: Эндо, ВСА, МПА (для энтеробактерий) и элективно-солевой агар (для стафилококков) в соответствии с действующими инструкциями.
Микрофлора, выделенная в инкубаториях птицефабрик Западной Сибири, представлена патогенными и условно-патогенными микроорганизмами (рис. 1).
Наибольшее количество выделенных культур относится к представителям родов Staphylocоссus и Streptococcus - 26,4%. Остальные 47,2% выделенных культур приходится на семейство Enterobacteriаceae. Из общего числа выделенных культур на долю кишечной палочки - 15,7%. По антигенной структуре штаммы E. coli относились к серотипам О2:К2; О6:К15; О159:К; О32:К; О164:К; О115:К; О152:К.
Значительное количество выделенных культур относится к роду Citrobacter - 14,8%. Из них в 10,7% случаях выделен вид Citrobacter freundii и в 4,1% - Citrobacter diversus. Представители рода Enterobacter выделены в 11,6% случаях, наибольшее количество культур приходится на Enterobacter cloacae - 9,1%. Штаммы из рода Proteus изолированы в 4,9% случаях, при этом преобладал вид Proteus mirabilis.
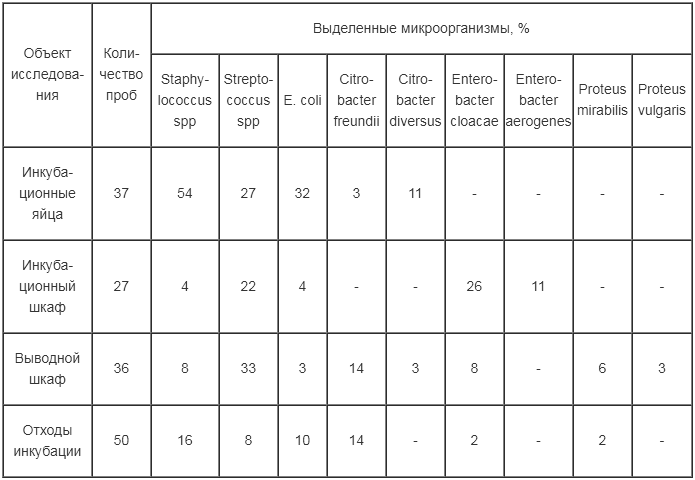
При анализе микрофлоры в смывах с поверхности инкубационных яиц преобладали Staphylocоссus spp – 54%, E. coli -32% и Streptococcus sрp - 27% (табл. 1). В инкубационных шкафах доминирующими видами являлись микроорганизмы из рода Enterobacter и Streptococcus sрp. Наибольшее количество различных видов микроорганизмов регистрировали в выводных шкафах: Streptococcus sрp - 33%, Citrobacter freundii - 14%, Staphylocоссus spp и Enterobacter cloacae по 8%. При исследовании отходов инкубации наиболее часто идентифицировали Staphylocоссus spp. – 16%, Citrobacter freundii - 14% и E. coli - 10 %.
|
|
Таблиця 1
Склад мікрофлори в залежності від об’єкту дослідження
|
Таблица 1
Состав микрофлоры в зависимости от объекта исследования
|
|
Визначено чутливість виділених польових штамів мікроорганізмів до 5-ти дезінфікуючих препаратів (табл. 2).
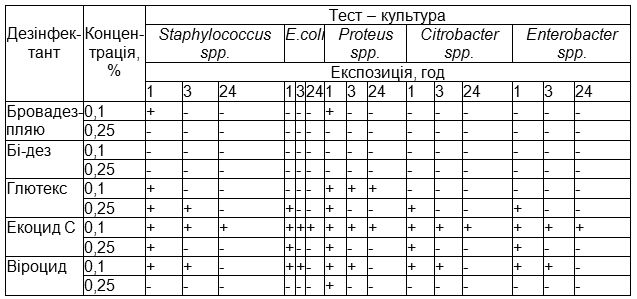
Примітка: (+) – наявність росту тест-культур, (-) – відсутність росту тест-культур.
Екоцид С 0,25 % концентрації володів вираженою бактерицидною дією відносно всіх досліджуваних культур при експозиції 3 год. При концентраціях 0,1% не знезаражуються тест-об'єкти від досліджуваних культур.
|
Определена чувствительность выделенных полевых штаммов микроорганизмов к 5-ти дезинфицирующим препаратам (табл. 2).
Таблица 2
Бактерицидная активность препаратов в отношении полевых тест-культур
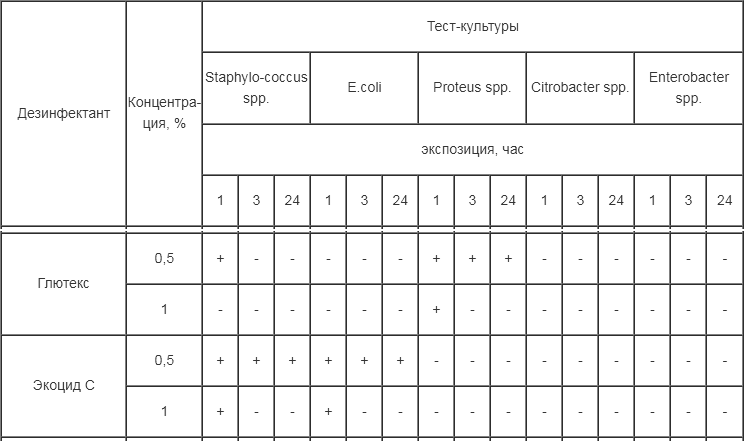
Примечание: (+) – наличие роста тест-культур, (-) – отсутствие роста тест-культур.
...
Экоцид С 1%-ной концентрации обладал выраженным бактерицидным действием в отношении всех испытуемых культур в при экспозиции три часа. При концентрациях 0,5% не обеззараживал тест-объекты от стафилококка и кишечной палочки.
|
|
Висновки.
1. Мікробіологічний моніторинг у інкубаторіях птахофабрик Північно-Східного регіону дозволив встановити, що домінуючими мікроорганізмами є Streptococcus sрp. – 26,4%, Staphylocоссus spp – 26,4%, E. coli – 32%, Citrobacter – 14,8%. У процесі інкубації відбувається збільшення кількісного та видового складу мікрофлори, яке досягає максимуму при виводі.
2. Виділені культури мікроорганізмів виявляють неоднакову чутливість до різних дезінфікуючих препаратів. Найбільш ефективну бактерицидну активність по відношенню до польових тест-культур показали Бровадез-плюс та Бі-дез.
|
Микробиологический мониторинг в инкубаториях птицефабрик Западной Сибири позволил установить, что доминирующими микроорганизмами являются Streptococcus sрp. - 26,4%, Staphylocоссus spp - 26,4%, E. coli -32%, Citrobacter - 14,8%. В процессе инкубации происходит увеличение количественного и видового состав микрофлоры, которое достигает максимума при выводе. Выделенные культуры микроорганизмов проявляют неодинаковую чувствительность к различным дезинфицирующим препаратам. Регистрируются штаммы, устойчивые к воздействию дезинфиктантов. Наиболее активны в отношении выделенной микрофлоры - дирак плюс, глютекс, экоцид С.
|
Тобто за результатами Г. Фотіної і І. Коваленко «вираженою бактерицидною дією відносно всіх досліджуваних культур при експозиції 3 год.» володів (до речі, грамотніше казати – мав дію, а не володів) екоцид С 0,25 % концентрації, тоді як в роботі Лиско С.Б. і Макарової О.А. таку саму дію мав екоцид С у концентрації 1%, і це викликає великі сумніви.
Ну а однаковий процент зараження такими самими бактеріями у птахів Західного Сибіру та птахів Північно-Східного регіону України – це щось… Як там у російських дисертаціях – міняють м’ясо на шоколад – і «в шоколаді». І наші вчені не ликом шиті, повністю переписують чужі висновки!
Ганьба плагіаторам Фотіній Ганні Анатоліївні, Коваленко Ірині Володимирівні та вченим, що це прикривають – Касічу Володимиру Юрійовичу, Березовському Андрію Володимировичу, Фотіній Тетяні Іванівні!
Ольга Дух
(літ. обробка, додаткові матеріали – Олег Смірнов)
|









